Пункция бедренной артерии гематома
Эндоваскулярные вмешательства, несмотря на ряд преимуществ перед открытым хирургическим лечением, являются инвазивными методиками и предполагают такие осложнения, как пульсирующие гематомы и ложные аневризмы периферических сосудов, причем их количество увеличивается пропорционально распространению ангиографических методов диагностики и лечения [1, 3–7]. По данным литературы в структуре местных осложнений после пункции артерии ложные аневризмы занимают 60–80% [5]. Для снижения частоты осложнений в настоящее время чаще используют трансаксиллярный, трансбрахиальный и трансрадиальный доступы, ушивающие инструменты. Однако и при таких доступах и развитии эндоваскулярных технологий отмечены повреждения пунктируемой артерии [4–7]. На сегодняшний день актуальными видами лечения пульсирующих гематом и ложных аневризм являются хирургический и компрессионный методы с различными их модификациями [1, 3–5].
Цель работы: проанализировать результаты хирургического и компрессионного методов лечения ложных аневризм и пульсирующих гематом периферических артерий после эндоваскулярных вмешательств.
Материалы и методы исследования
Проанализированы результаты лечения 87 больных с пульсирующими гематомами и ложными аневризмами, находившихся в институте им. Н. В. Склифосовского с 2010 г. по январь 2018 г., в возрасте от 40 до 83 лет. У всех пациентов причиной патологии являлись эндоваскулярные вмешательства, 69 (79,3%) из которых выполнены в других лечебных учреждениях, с последующим поступлением по экстренным показаниям в сроки после манипуляций от 4 суток до 2 месяцев. Большая часть ложных аневризм (23 (88,5%) из 26 случаев) выявлена у пациентов с выполненными эндоваскулярными вмешательствами на коронарных артериях, причем у 14 (53,8%) больных с ложной аневризмой из 23 пациентов было выполнено стентирование коронарных артерий на фоне приема дезагрегантных препаратов (клопидогрел (Плавикс)).
Локализация повреждения: бедренная артерия в 75 случаях (86,2%), подмышечная артерия — 9 (10,3%), плечевая артерия — 2 (2,3%), в одном случае лучевая артерия. Из подтвержденной сопутствующей патологии артериальная гипертензия отмечена у 79 пациентов (90,8%); ожирение II–III степени у 21 (24,1%); сахарный диабет 2 типа средней тяжести у 25 (28,7%); атеросклеротический постинфарктный кардиосклероз у 44 пациентов (50,6%). Атеросклероз артерий нижних конечностей (гемодинамически значимые стенозы/окклюзия поверхностной бедренной артерии) выявлен у 38 больных (43,7%). Прием антикоагулянтных (варфарин, Ксарелто) и дезагрегантных препаратов (клопидогрел (Плавикс, Зилт)) до эндоваскулярных вмешательств отмечен у 61 (70,1%) пациента из 87.
Диагноз ложной аневризмы был установлен 26 (29,9%) больным, пульсирующей гематомы — 61 (70,1%).
При опросе пациентов при поступлении и первичном осмотре обращали внимание на наличие болезненности и припухлости в области выполненной пункции, пульсирующего образования и изменения кожных покровов над ним, систолического шума в области образования. При анализе анамнеза каждого пациента уделяли внимание таким моментам, как давность и объем эндоваскулярного вмешательства; сроки пребывания в стационаре. Ультразвуковое исследование было первым и основным этапом инструментального обследования пациентов. Исследование проведено на ультразвуковой системе Philips iU 22 мультичастотными линейными датчиками L9 — 3 МГц, L15 — 7 МГц.
При выполнении ультразвукового исследования оценивали размеры и количество полостей; длину и диаметр шейки ложной аневризмы (сообщение с сосудом), размер дефекта стенки сосуда, наличие атеросклеротических бляшек в просвете пунктированной артерии (рис. 1).
.png)
.png) При установлении диагноза «ложная аневризма» с целью уточнения локализации поврежденной артерии, подозрения на артериовенозную форму аневризмы, а также решения вопроса о выборе хирургического метода лечения выполняли ангиографию и/или КТ-ангиографию (рис. 2).
При установлении диагноза «ложная аневризма» с целью уточнения локализации поврежденной артерии, подозрения на артериовенозную форму аневризмы, а также решения вопроса о выборе хирургического метода лечения выполняли ангиографию и/или КТ-ангиографию (рис. 2).
Под пульсирующей гематомой понимали пульсирующее опухолевидное образование (до 3,0 см в диаметре) в области пункции с экхимозом и болью в области пункции в сроки от 2–5 суток после вмешательства или ограниченное/диффузное выпячивание сосудистой стенки либо полость, образовавшуюся около стенки сосуда, сообщающуюся с ее просветом в сроки от 2 до 5 суток после манипуляции. Постпункционной ложной аневризмой считали патологическую полость в окружающих тканях, образовавшуюся путем организации околососудистой гематомы вследствие дефекта артериальной стенки и сообщающейся с просветом артерии, в сроки после 17 дней с момента манипуляции.
Результаты исследования
.png) Всем пациентам с пульсирующей гематомой лечение начинали с локальной компрессии давящей повязкой. Дополнительная компрессия системой бедренного сжатия «CompressAR StrongArm tm System» выполнена 14 (22,9%) пациентам из этой группы. Положительным результатом считали тромбоз полости пульсирующей гематомы и отсутствие сообщающегося кровотока с дефектом стенки артерии по данным ультразвукового исследования. Положительный результат получен у 56 (91,8%) больных с пульсирующей гематомой. В первые двое суток проводили попытки локальной компрессии у пациентов с ложными аневризмами. Однако они оказались не эффективны, сопровождались болевым синдромом, пациенты были оперированы (рис. 4).
Всем пациентам с пульсирующей гематомой лечение начинали с локальной компрессии давящей повязкой. Дополнительная компрессия системой бедренного сжатия «CompressAR StrongArm tm System» выполнена 14 (22,9%) пациентам из этой группы. Положительным результатом считали тромбоз полости пульсирующей гематомы и отсутствие сообщающегося кровотока с дефектом стенки артерии по данным ультразвукового исследования. Положительный результат получен у 56 (91,8%) больных с пульсирующей гематомой. В первые двое суток проводили попытки локальной компрессии у пациентов с ложными аневризмами. Однако они оказались не эффективны, сопровождались болевым синдромом, пациенты были оперированы (рис. 4).
Открытое хирургическое лечение выполнено 31 (35,6%) больному, из них 26 пациентов с ложной аневризмой (рис. 5–6) и 5 с пульсирующей гематомой. Сроки выполнения реконструктивной сосудистой операции варьировались от 1 часа до 7 суток. Структура оперативных вмешательств: сосудистый шов артериального дефекта — 28 (90,3%); реконструкция артерии — 3 (9,7%). У всех пациентов удалось добиться восстановления целостности сосуда.
.gif)
.png)
На исход лечения влияли: прием дезагрегантных и антикоагулянтных препаратов и их дозировка до и после эндоваскулярных вмешательств; конституциональные особенности больного, артериальная гипертензия, атеросклеротическое поражение артерии. Положительный исход компрессионного лечения зависел также от величины дефекта артерии, который оценивали по данным ультразвукового метода. При размере дефекта 1–2 мм положительный результат у 46 (92%), при размере 2,1–3 мм — у 4 больных (8%). Эффективность оперативного лечения составила 100%. В послеоперационном периоде был один летальный исход вследствие декомпенсации основного заболевания на фоне до- и интраоперацонной кровопотери; у одного пациента развилась ишемическая гангрена нижней конечности (декомпенсированное кровообращение при поступлении (сахарный диабет)); у трех пациентов отмечалась кожная гиперестезия с последующим регрессом симптоматики через один месяц. Несостоятельности кожных швов, нагноений, лимфорреи, кровотечения из послеоперационной раны не было.
Обсуждение
.png) В настоящее время общероссийские и региональные программы оказания специализированной медицинской помощи ориентированы на повсеместное внедрение эндоваскулярных технологий в диагностический и лечебный процесс сердечно-сосудистых заболеваний [1, 2, 5–7]. Также появляются новые лекарственные средства в антитромботической терапии, разнообразные по механизмам действия и влияющие на все звенья гемостаза [6, 7]. В условиях данной тенденции повышается риск геморрагических осложнений в месте пункции сосуда [1–7]. Несмотря на существующие руководства по методике выполнения эндоваскулярных вмешательств, методы профилактики осложнений, национальные рекомендации, различные ушивающие устройства пациентов с пульсирующими гематомами и ложными аневризмами после эндоваскулярных вмешательств меньше не становится [1, 3–7]. В большинстве научных публикаций не было найдено единого алгоритма по лечению данной патологии при различной локализации на периферических артериях. Также существуют разночтения в сроках формирования ложной аневризмы из пульсирующей гематомы, отсутствие четкого определения термина «ложная аневризма» и «пульсирующая гематома», что зачастую приводит к различному трактованию диагноза и затруднению в правильном выборе тактики и лечения [1]. В данной работе мы попытались проанализировать методы лечения пациентов с данной патологией, определить и систематизировать наиболее подходящую тактику ведения таких больных, выявить оптимальный метод лечения в имеющихся условиях НИИ СП им. Н. В. Склифосовского. На наш взгляд, открытые реконструктивные операции являются оптимальным выбором в лечении ложных аневризм периферических артерий после эндоваскулярных вмешательств, особенно осложненных форм, так как позволяют резецировать саму аневризму с последующим удалением аневризматического мешка и, как следствие, устранить причину сдавления окружающих тканей, в отличие от малоинвазивных методик. Немаловажным является соблюдение мер профилактики после пункционной ангиографии и трансартериальных лечебно-диагностических процедур (давящая повязка, покой конечности, постельный режим и др.), пациентоориентированная беседа с больным до и после манипуляций, которая позволяет значительно уменьшить число постпункционных гематом и последующих ложных аневризм.
В настоящее время общероссийские и региональные программы оказания специализированной медицинской помощи ориентированы на повсеместное внедрение эндоваскулярных технологий в диагностический и лечебный процесс сердечно-сосудистых заболеваний [1, 2, 5–7]. Также появляются новые лекарственные средства в антитромботической терапии, разнообразные по механизмам действия и влияющие на все звенья гемостаза [6, 7]. В условиях данной тенденции повышается риск геморрагических осложнений в месте пункции сосуда [1–7]. Несмотря на существующие руководства по методике выполнения эндоваскулярных вмешательств, методы профилактики осложнений, национальные рекомендации, различные ушивающие устройства пациентов с пульсирующими гематомами и ложными аневризмами после эндоваскулярных вмешательств меньше не становится [1, 3–7]. В большинстве научных публикаций не было найдено единого алгоритма по лечению данной патологии при различной локализации на периферических артериях. Также существуют разночтения в сроках формирования ложной аневризмы из пульсирующей гематомы, отсутствие четкого определения термина «ложная аневризма» и «пульсирующая гематома», что зачастую приводит к различному трактованию диагноза и затруднению в правильном выборе тактики и лечения [1]. В данной работе мы попытались проанализировать методы лечения пациентов с данной патологией, определить и систематизировать наиболее подходящую тактику ведения таких больных, выявить оптимальный метод лечения в имеющихся условиях НИИ СП им. Н. В. Склифосовского. На наш взгляд, открытые реконструктивные операции являются оптимальным выбором в лечении ложных аневризм периферических артерий после эндоваскулярных вмешательств, особенно осложненных форм, так как позволяют резецировать саму аневризму с последующим удалением аневризматического мешка и, как следствие, устранить причину сдавления окружающих тканей, в отличие от малоинвазивных методик. Немаловажным является соблюдение мер профилактики после пункционной ангиографии и трансартериальных лечебно-диагностических процедур (давящая повязка, покой конечности, постельный режим и др.), пациентоориентированная беседа с больным до и после манипуляций, которая позволяет значительно уменьшить число постпункционных гематом и последующих ложных аневризм.
Выводы
- Основным и первым методом лечения пульсирующих гематом является локальная компрессия в течение суток с последующим ультразвуковым контролем.
- На эффективность локальной компрессии влияет прием пациентом антикоагулянтных и дезагрегантных препаратов, конституциональные особенности больного, артериальная гипертензия, локализация и диаметр постпункционного дефекта артерии, комплаентность больного.
- Компрессионное лечение эффективно у больных с пульсирующей гематомой при размере дефекта стенки артерии до 2 мм; при размере дефекта артерии более 2 мм результативно хирургическое лечение.
- Открытое хирургическое лечение эффективно в 100% случаев и является основным методом в лечении ложных аневризм периферических артерий.
Литература
- Гавриленко А. В., Синявин Г. В. Лечение ложных ятрогенных артериальных аневризм // Ангиология и сосудистая хирургия. 2005; 135–138.
- Бочаров С. М. Ангиографическая диагностика и эндоваскулярное лечение при травме артерий. Автореф. дис. … канд. мед. наук. М., 2009. 24 с.
- Seidel A. C., Miranda F. Jr., Fregadolli L. V. Atrogenic pseudoaneurysm of axillary artery // Arg. Bras. Cardiol. 2006; 86 (4): 303–305.
- Houlind K., Jepsen J M., Saicu C. et al. Current management of inguinal false aneurysms//J. Cardiovascular. Surg. 2017; 58 (2): 278–283.
- Панфилов Д. С., Козлов Б. Н., Панфилов С. Д. и др. Проблема лечения постпункционных ложных аневризм: компрессионный, хирургический, пункционный подходы // Сибирский мед. журнал. 2012; 27 (1): 39–44.
- Фокин А. А., Киреев К. А., Москвичева М. Г., Киреева Т. С. Профилактика постпункционных ятрогенных ложных аневризм бедренных артерий после коронарных вмешательств при инфаркте миокарда // Ангиология и сосудистая хирургия. 2016; 22 (2): 139–144.
- Михайлов И. П., Исаев Г. А., Коков Л. С. и др. Использование системного тромболизиса для лечения острой ишемии конечностей // Неотложная медицинская помощь. 2015; 2: 32–34.
Ю. А. Виноградова1
Л. С. Коков, доктор медицинских наук, профессор, член-корреспондент РАН
И. П. Михайлов, доктор медицинских наук, профессор
В. П. Кирющенков
Е. В. Трошкина
ГБУЗ НИИ СП им. Н. В. Склифосовского ДЗМ, Москва
1 Контактная информация: weinstadt235@gmail.com
Методы лечения пульсирующих гематом и ложных аневризм периферических артерий после рентгенэндоваскулярных вмешательств/ Ю. А. Виноградова, Л. С. Коков, И. П. Михайлов, В. П. Кирющенков, Е. В. Трошкина
Для цитирования: Лечащий врач № 7/2018; Номера страниц в выпуске: 21-24
Теги: периферические артерии, осложнения, диагностика, стентирование
Источник
Артериальный доступ. Пункция артерий
Как и при венозном доступе, доступ через артериальное русло применяется с различными целями:
• для внутриартериального переливания крови;
• при катетеризации артерий.
Для внутриартериальной инфузии используют сосуды, наиболее близкие к сердцу. Внутриартериальное переливание крови технически сложнее, чем внутривенное. Кроме того, возможны осложнения в виде повреждения и тромбирования артериальных стволов. В связи с этим в настоящее время данный метод практически не применяется.
Показания:
• клиническая смерть вследствие массивной невосполненной кровопотери;
• терминальное состояние при шоках любой этиологии (АД составляет 60 мм рт. ст. и ниже);
• нет доступа к венам.
Преимущества. Данный доступ позволяет переливать достаточное количество трансфузионной среды в сосудистое русло в максимально сжатые сроки. Непосредственное снабжение кровью сосудов головного мозга и коронарных сосудов. Рефлекторная стимуляция сердечной деятельности. Кроме того, необходимо отметить, что диаметр игл при артериальном доступе значительно меньше, чем при венозном.
Пункция артерий
Необходимость в данной манипуляции возникает при:
• получении проб артериальной крови;
• прямой регистрации артериального давления;
• введении контрастных веществ в случаях проведения определенных методов обследования.
Наиболее часто используется пункция лучевой и бедренной артерий.
Пункция лучевой артерии
Применяется чаще всего, так как в этом случае даже при нарушении кровообращения в лучевой артерии обычно не изменяется кровоснабжение кисти. Перед пункцией надо убедиться в нормальном функционировании локтевой артерии и ее анастомозов с ладонной дугой — тест Аллена на адекватность коллатерального кровообращения: пережимают локтевую и лучевую артерии пальцами так, чтобы кровь по венам оттекла от кисти и она побледнела. Больного просят несколько раз сжать и разжать ладонь. При этом ладонь приобретает мертвенно-бледный оттенок. Освобождают локтевую артерию, и при достаточном коллатеральном кровообращении, несмотря на пережатую лучевую артерию, нормальный цвет кожи восстанавливается через 5—10 с. Если же окраска руки не вернется за это время к исходной, тест Аллена считается отрицательным, что указывает на окклюзию лучевой артерии.
Анатомия. Лучевая и локтевая артерии являются ветвями плечевой артерии и снабжают кровью кисть через поверхностную и глубокую ладонную дугу. Лучевая артерия расположена вдоль латерального края предплечья, пальпируется на запястье у дистального конца лучевой кости. Здесь она покрыта лишь фасцией и кожей.
Ход пункции. Кисть разгибают в лучезапястном суставе, укладывают на валик, определяют пульсацию артерий. Кожу и подкожную клетчатку инфильтрируют раствором анестетика, так как пункция артерий является болезненной для пациента процедурой. Анестезия устраняет также артериальный спазм. Сосуд фиксируют между указательным и средним пальцами, иглу вводят в проксимальном направлении под углом 45° к горизонтальной плоскости. При медленном приближении к артерии возникает ощущение передаточной пульсации. Иглу продвигают до появления крови. Более опытный врач может пунктировать артерию под прямым углом, что снижает до минимума травму артерии. На нахождение иглы в артерии указывает поступление в шприц алой пульсирующей крови.
Пункция бедренной артерии
Анатомия. Бедренная артерия является продолжением ствола наружной подвздошной артерии. Артерия пересекает середину линии, проведенной от передней верхней ости подвздошной кости к лонному сочленению. Медиальнее артерии лежит бедренная вена, оба сосуда проходят вместе в скарповском треугольнике.
Ход пункции. Бедренная вена пунктируется у пупартовой связки (паховой). Используют крупную иглу диаметром 1,2 мм.
Для удобства манипуляции иглу насаживают на шприц. Средним и указательным пальцами левой руки прощупывают пульсацию стенки сосуда. Иглу вводят между пальцами срезом вниз во избежание прокола противоположной стенки и направляют под небольшим углом к коже. Как только игла проникает в просвет артерии, кровь под сильным давлением поступает в шприц. После этого шприц отсоединяют и приступают к дальнейшим необходимым мероприятиям (трансфузия, катетеризация).
Учебное видео анатомии бедренной артерии и ее ветвей

— Также рекомендуем «Осложнения пункции артерий. Секция артерий»
Оглавление темы «Артериальный доступ в трансфузиологии»:
1. Катетеризация вен. Способы введения катетеров
2. Осложнения катетеризации вен. Перфорации и тромбировании вен
3. Периферический венозный доступ. Центральный венозный доступ
4. Интрамедуллярный доступ. Переливания в костный мозг
5. Артериальный доступ. Пункция артерий
6. Осложнения пункции артерий. Секция артерий
7. Катетеризация лучевой артерии. Катетеризация бедренной артерии
Источник
Введение
Катетеризация бедренной артерии стала применяться в интенсивной терапии в конце 70-х годов прошлого века [10;13]. В связи с широким распространением системы PICCO-мониторинга в течение последнего десятилетия катетеризация бедренной артерии стала рутинной манипуляцией в интенсивной терапии. По данным литературы, при пункции и катетеризации возможно развитие целого ряда осложнений, в том числе, потенциально летальных [16;18]. Геморрагические осложнения являются наиболее опасными. Ниже приведено описание клинического наблюдения геморрагического осложнения длительной катетеризации бедренной артерии при проведении PICCO-мониторинга у тяжелого нейрореанимационного больного, которое проявилось формированием обширной гематомы бедра. В литературе отсутствуют сообщения о развитии такого осложнения при использовании системы PICCO.Пациент Д., 55 лет, поступил в Институт нейрохирургии для хирургического лечения аденокарциномы краниофациальной локализации. При поступлении отмечались умеренные эмоционально-личностные нарушения и очаговая неврологическая симптоматика в виде монопареза в левой ноге до 4 баллов. При КТ-исследовании головного мозга выявлялась опухоль основания передней черепной ямки с выраженным перифокальным отеком (Рисунок 1).
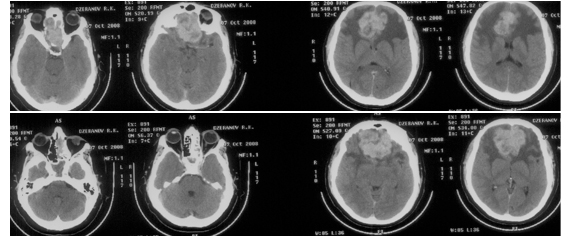
Опухоль распространялась в решетчатый лабиринт и полость носа преимущественно слева. Сопутствующая патология была представлена ожирением I степени.За 30 минут до операции выполнена премедикация: внутримышечно дормикум 5 мг и супрастин 20 мг. В операционной катетеризирована кубитальная вена периферическим катетером 16 G. Индукция анестезии проводилась дормикумом 5 мг, фентанил 0,2 мг, пропофол 150 мг, ардуан 2 мг и листенон 200 мг. Поддержание анестезии проводилось фентанилом в дозе 0,7 мг/час, пропофолом 400-600 мг/час. Катетеризирована правая подключичная вена трекпросветным катетером.Во время оперативного вмешательства отмечалось напряжение твердой мозговой оболочки, а при ее рассечении мозг выбухал и не пульсировал. Опухоль была плотной консистенции и обильно васкуляризирована. После удаления медиобазальной части опухоли развилось интенсивное артериальное кровотечение и вспучивание мозга. Источником кровотечения оказалась правая фронтополярная артерия, которая была коагулирована. Опухоль была удалена полностью. Кровопотеря составила около 1500 мл и была адекватно восполнена интраоперационно.
1 сутки после операции. Перед транспортировкой пациента в отделение интенсивной терпаии было выполнено контрольное КТ-исследование головного мозга, выявившее диффузный отек мозга с компрессией базальных цистерн и умеренное расширение боковых желудочков(Рисунок 2).
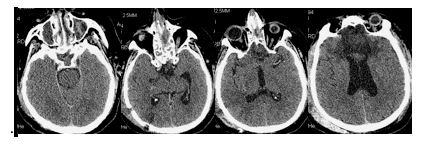
В связи с коматозным состоянием и учитывая результаты КТ-исследования головного мозга, был начат мониторинг внутричерепного давления при помощи паренхиматозного датчика (Codman, USA). Через 6 часов развилась артериальная гипотензия, потребовавшая инфузии симпатомиметических препаратов, затем присоединилась устойчивая внутричерепная гипертензия, резистентная к седации, аналгезии, миорелаксации и применению осмотической терапии. Выполнено повторное КТ-исследование головного мозга, и затем был установлен наружный вентрикулярный дренаж в задний рог правого бокового желудочка (Рисунок 3).
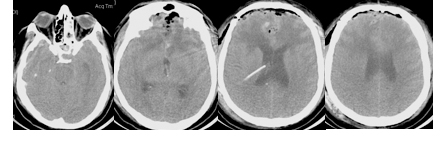
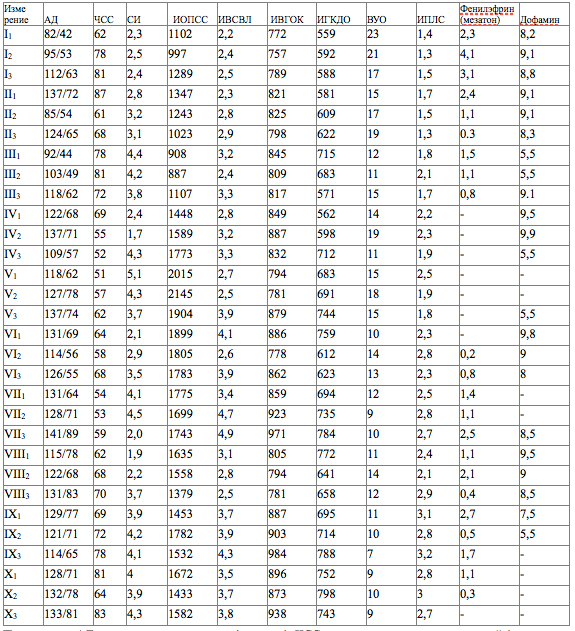
Вентрикулярное дренирование вместе с проводимой интенсивной терапией позволило поддерживать уровень ВЧД в пределах 12 – 18 мм.рт.ст. В связи с устойчивой тенденцией к артериальной гипотензии, требующей проведения инфузионной терапии и использования симпатомиметических препаратов (фенилэфрин, дофамин), был начат PICCO-мониторинг. В асептических условиях была пунктирована правая бедренная артерия с первой попытки. Пункция выполнена 3 см ниже паховой связки под углом 35-40˚ к поверхности кожи. Артериальная кровь была получена при продвижении иглы вперед, а не при ее извлечении, что косвенно свидетельствует об отсутствии повреждения задней стенки артерии. Артериальный катетер диаметром 5 Fr с первой попытки был установлен в правую бедренную артерию по методу Сельдингера и фиксирован к коже двумя швами.2 – 10 сутки после операции. Состояние оставалось крайне тяжелым, нестабильным. Сохранялось коматозное состояние. На фоне наружного вентрикулярного дренирования и методами интенсивной терапии удавалось поддерживать ВЧД в пределах 10 – 15 мм.рт.ст. Сохранялась устойчивая тенденция к артериальной гипотензии и появилась брадикардия. Продолжался инвазивный мониторинг центральной гемодинамики при помощи системы PICCO (Таблица 1).

Примечание: АД – артериальное давление (мм.рт.ст.); ЧСС – частота сердечных сокращений (ударов в мин); СИ – сердечный индекс (норма: 3–5 мл/мин/м2); ИОПСС – индекс общего перефирического сосудистого сопротивления (норма: 1200-1800динсексм5*м2); ИВСВЛ – индекс внесосудистой воды легких (норма: 3-7 мл/кг/м2); ИВГОК – индекс внутригрудного объема крови (норма: 850-1000 мл/м2); ИГКДО – индекс глобального конечно-диастолического объема (норма: 680-800 мл/м2); ВУО – вариация ударного объема (норма: ≤10%); ИПЛС – индекс проницаемости легочных сосудов (норма: 1,0-3,0); Дозы фенилэфрина и дофамина представлены в мкг/кг/мин.
Продолжалась ИВЛ в синхронизированном режиме. Развилась двусторонняя пневмония и двусторонний гидроторакс, более выраженный справа. Была начата антибактериальная терапия, дренирована правая плевральная полость. Развился парез желудочно-кишечного тракта. Появилась гипонатриемия. В плазме были снижены уровни кортизола (274 нмоль/л), Т3 (<0,62 нмоль/л), Т4 (29,1 нмоль/л), свТ3 (1,84 пмоль/л), свТ4 (9,09 пмоль/л). Была назначена заместительная гормональная терапия глюкокортикостероидными (гидрокортизон 200 мг/сут) и тиреоидными (L-тироксин 150 мкг/сут) препаратами.На 7 сутки после операции были назначены низкомолекулярные гепарины в профилактической дозе (клексан 80 мг/сут) в связи с наличием высокого риска развития тромбоэмболических осложнений (длительная иммобилизация пациента, ожирение, наличие аденокарциномы, терапия гормональными препаратами).
На 10 сутки после операции развилась гематома мягких тканей бедра в области стояния артериального катетера с распространением кзади и медиально. Это осложнение было связано с артериальным бедренным катетером. К сожалению, было невозможно раньше завершить проведение инвазивного мониторинга, поскольку гемодинамический профиль в этот период часто изменялся, что требовало неоднократной коррекции доз и комбинации симпатомиметических препаратов (фенилэфрин/дофамин) в течение суток. Причиной такой нестабильности параметров центральной гемодинамики было: нарушение центральных механизмов регуляции АД, синдром системной воспальтельной реакции вследствие пневмонии, гормональная недостаточность. На фоне проводимой интенсивной терапии показатели центральной гемодинамики относительно стабилизировались к 10 суткам. Это позволило прекратить PICCO-мониторинг и удалить бедренный артериальный катетер. Для гемостаза использовалась механическая компрессия: пальцевое прижатие места катетеризации в течение 20 мин, а затем – давящая повязка в течение суток. По данным УЗИ объем гематомы оценивался около 500 мл. Гематома располагалась вокруг бедренной артерией, распространялась от пупартовой связки до нижней трети бедра и не оказывала компрессии на бедренную вену. С учетом отсутствия нарушений венозного оттока и тяжести состояния пациента, сосудистым хирургом была выбрана выжидательная тактика.11 – 30 сутки. Сохранялось бессознательное состояние. При исследовании ликвора не было получено данных за воспалительные изменения. Системная гемодинамика оставалась стабильной. Продолжалась ИВЛ. Удалось добиться регресса пневмонии. Отмечалась анемия. Уровень гемоглобина неоднократно снижался до 4,6 – 7,1 г/дл, несмотря на многократно проводимые гемотрансфузии.
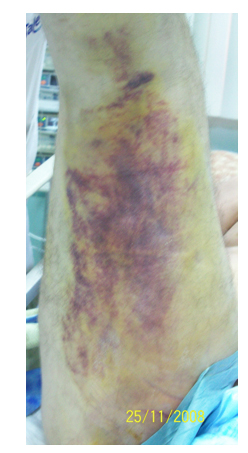
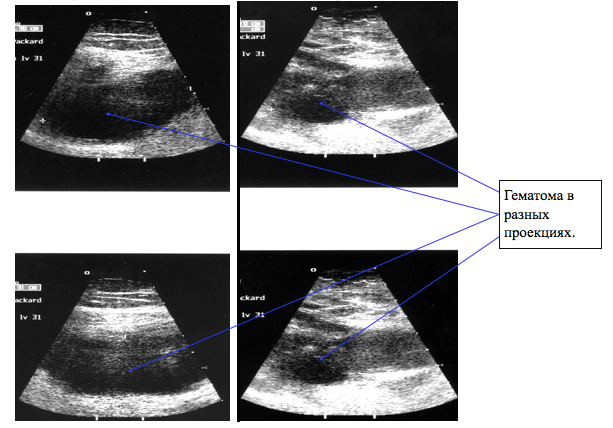
В этот период гематома бедра визуально увеличилась (Рисунок 4), а, по данным УЗИ, ее объем приблизительно оценивался уже в 1500 мл (Рисунок 5).
Однако, нарушений венозного оттока не было. Пациент продолжал получать низкомолекулярные гепарины, поскольку гематома вокруг магистральных сосудов является дополнительным фактором риска развития тромботических осложнений [14].31 – 36 сутки. Состояние принципиально не изменялось. Сохранялся вегетативный статус. По данным УЗИ объем гематомы бедра не увеличивался. Анемии в этот период не отмечалось.37 сутки. Состояние резко ухудшилось. Развилась артериальная гипотензия, десинхронизация с респиратором, гектическая лихорадка. При исследовании ликвора был диагностирован бактериальный менигит. Корригирована антибактериальная терапия. Сформировалась резистентная артериальная гипотензия, произошла остановка сердечной деятельности. Реанимационные мероприятия оказались безуспешными. При микробиологическом исследовании ликвора был диагностирован ацинетобактерный менингоэнцефалит, который и явился причиной летального исхода.
Обсуждение
Приведенное клиническое наблюдение иллюстрирует развитие обширной гематомы бедра вследствие длительной катетеризации бедренной артерии. По данным литературы, геморрагические осложнения при этой манипуляции развиваются в 2 – 12%, они могут быть жизненноопасными, приводить к утяжелению течения послеоперационного периода и увеличению частоты гемотрансфузий [4;10;13;14]. Причины геморрагических осложнений следующие:ошибки, допущенные в момент пункции и катетеризации артерии;наличие факторов риска, увеличивающих вероятность осложнений в течение катетеризации или после удаления катетера.
При высокой пункции артерии, непосредственно ниже паховой связки достоверно повышается риск развития такого серьезного и потенциально летального осложнения, как забрюшинное кровотечение [1;3]. При повторных пункциях артерии увеличиваются риск развития любых геморрагических осложнений [14]. Сквозная пункция артерии, когда прокалывается задняя стенка артерии вслед за передней, также повышает риск развития геморрагических осложнений и может, более того, приводить к неэффективности герметизирующих систем, о которых подробно будет сказано ниже. В приведенном наблюдении гематома развилась на 10 сутки катетеризации артерии, поэтому маловероятно, что причиной этого осложнения были технические ошибки катетеризации. Тем более, что при выполнении этой манипуляции не отмечалось каких-либо особенностей.
При нахождении катетера в артерии или после его удаления, по литературным данным, могут развиваться геморрагические осложнения. Однако для этого необходимо наличие таких факторов риска, как прием антикоагулянтов, антиаггрегантов, фибринолитических препаратов или наличие эпизодов артериальной гипертензии [1;16]. Казалось бы, логично предполагать, что длительная катетеризация артерии также приводит к увеличению частоты геморрагических осложнений. Однако еще на заре использования бедренной артерии для инвазивного мониторинга гемодинамики в интенсивной терапии была показана безопасность длительной катетеризации [10;13]. Нам не удалось найти работ, опровергающих это мнение. Поэтому мы считаем, что вынужденно длительная катетеризация в приведенном наблюдении не являлась причиной развития гематомы бедра.
Известно, что артериальная гипертензия может приводить к развитию геморрагических осложнений катетеризации артерии. Однако в приведенном наблюдении, напротив, была артериальная гипотензия. Поэтому этот фактор риска не мог привести к развитию гематомы. В то же время в связи с высоким риском развития тромбоэмболических осложнений пациент нуждался в терапии низкомолекулярными гепаринами (НМГ). Клексан был назначен на 7 сутки после операции. Гематома начала развиваться спустя 3 дня от начала терапии НМГ, а после удаления катетера гематома только продолжала увеличиваться в объеме. Наиболее вероятно, антикоагулянтная терапия и стала в приведенном наблюдении значимым фактором риска развития гематомы.
Формирование описываемого осложнения привело к повторным гемотрансфузиям и более тяжелому течению послеоперационного периода, поскольку при лизировании гематомы и всасывании продуктов распада крови развивается или усиливается интоксикация [15]. Гематома не удалялась, так как она не оказывала компрессии на венозные и артериальные сосуды. Осуществлялся динамический контроль объема гематомы и проходимости сосудов с помощью ультразвукового исследования. Использование НМГ продолжалось, поскольку известно, что гематома вокруг венозных сосудов увеличивает риск их тромбоза [14].
Геморрагические осложнения катетеризации бедренной артерии развиваются нередко, и могут существенно ухудшать течение и исход заболевания, поэтому вопрос профилактики этих осложнений остается актуальным. Профилактические мероприятия можно условно разделить на проводимые в момент катетеризации и при удалении катетера.При катетеризации артерии следует соблюдать следующие правила, которые позволяют не допустить развития осложнений. Во-первых, пунктировать артерию необходимо на 2-3 см ниже паховой связки. Во-вторых, нельзя многократно пунктировать артерию. В-третьих, следует избегать сквозной пункции артерии. Все это было соблюдено при выполнении катетеризации артерии, поэтому гематома не развилась в ранние сроки после манипуляции, а только на 10 сутки проведения мониторинга, когда катетер еще находился в артерии, но уже на фоне терапии НМГ. К сожалению, нам не удалось найти работ, которые бы описывали методы профилактики геморрагических осложнений при появлении гематомы на фоне продолжающейся катетеризации артерии. Однако следует отметить, что гематома значительно увеличилась уже после удаления катетера. Следовательно, можно предположить, что основной объем гематомы набрался из не закрывшегося после удаления катетера дефекта стенки артерии. Исходя из этого, этап удаления катетера из артерии представляется важным в профилактики развития геморрагических осложнений.
До 90-х годов прошлого века для профилактики кровотечения из дефекта артериальной стенки после извлечения катетера использовали механическую компрессию и различные бандажи. Это сопровождалось длительной, в течение нескольких часов или суток, иммобилизацией пациента и дискомфортом. В ряде наблюдений развивались различной выраженности кровотечения из дефекта артериальной стенки или другие осложнения. Для минимизации риска развития осложнений с 1991 года в клинической практике начали применяться различные герметизирующие системы. В настоящий момент доступно более 25 герметизирующих систем с различными принципами работы – аппликация коллагена, коллагена с тромбином или коллалена с анкором, наложение сосудистого шва, укладка гемостатических заплат и подушек, степлирование и клипирование дефекта сосудистой стенки. В течение последних 7 лет лидирующие положения заняли следующие герметизирующие системы: Duett, VasoSeal, AngioSeal, Perclose и StarClose [4;8;18]. StarClose является новейшей разработкой среди герметизирующих систем.В результате проведенных многоцентровых исследований не было выявлено достоверных отличий в частоте развития осложнений при использовании механической компрессии и различных герметизирующих систем нового поколения (AngioSeal, Perclose и StarClose) для общей группы пациентов [4;7;8;9;17;18]. В то же время при использовании системы StarClose у пациентов, получавших антиаггрегантную терапию (ингибиторы гликопротеина IIb-IIIa), достоверно уменьшалось время гемостаза и иммобилизации пациента по сравнению с механической компрессией области сосуда [5;11;12]. Однако следует отметить, что даже при использовании системы StarClose возможно развитие различных осложнений. Причиной этого является дислокация клипса [2;6;16;19]. Williams R с соавт., описавшие 12 наблюдений дислокации клипса, считают, это может происходить вследствие технического дефекта клипса, ожирения пациента или наличия рубцов в паховой области. В ряде наблюдений авторам не удалось выяснить причину дислокации клипса [19]. Однако даже с учетом частоты дислокации клипса применение системы StarClose приводит к уменьшению количества осложнений по сравнению с механической компрессией сосуда. Исходя из этого, в приведенном наблюдении при удалении катетера следовало использовать систему StarClose. Вероятно, это позволило бы избежать такого значительного увеличения объема гематомы. Следует помнить, что любая герметизирующая система, в том числе и StarClose, эффективна только в том случае, если при пункции не была повреждена задняя стенка артерии.
Заключение
- При катетеризации бедренной артерии следует строго следовать существующим правилам: пунктировать артерию на 2-3 см ниже паховой связки, избегать многократных пункций артерии и повреждения задней стенки артерии, что бывает при сквозной пункции.
- Применение антикоагулянтов, антиаггрегантов, тромболитических препаратов и эпизоды артериальной гипертензии являются факторами риска развития геморрагических осложнений. Герметизирующую систему StarClose необходимо использовать у больных после окончания проведения PICCO мониторинга при наличии вышеперечисленных факторов риска.
- Использование системы StarClose не исключает полностью вероятность развития геморрагических осложнений. Поэтому при катетеризации артерии, следует знать, какие осложнения возможны, как с ними бороться и иметь возможность коллегиального и быстрого обсуждения ситуации и ангиохирургом, эндовазальным и абдоминальным хирургом, специалистом ультразвуковой и лучевой диагностики.
Литература
- Кузьков В.В.
