Рецепторы растяжения рефлекс геринга
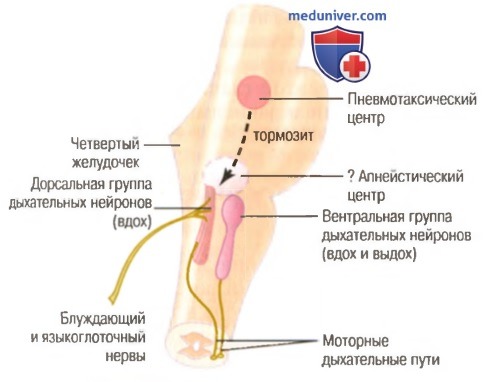
Пневмотаксический центр. Вентральная группа дыхательных нейронов
а) Пневмотаксический центр ограничивает длительность вдоха и увеличивает скорость дыхания. Расположенный дорсально в nucleus parabrachialis верхней части моста пневмотаксический центр передает сигналы в область вдоха. Главным в деятельности этого центра является контроль за точкой «выключения» нарастающего инспираторного сигнала и за длительностью фазы наполнения легких. При сильном пневмотаксическом сигнале вдох может укоротиться до 0,5 сек, чему соответствует очень малое наполнение легких; при слабом пневмотаксическом сигнале вдох может продолжаться 5 сек или более, и легкие наполняются большим количеством воздуха.
Первичной задачей пневмотаксического центра является ограничение вдоха. При этом возникает вторичный эффект — увеличение скорости дыхания, т.к. ограничение вдоха укорачивает длительность выдоха и общего периода каждого цикла дыхания. Сильный пневмотаксический сигнал может увеличивать частоту дыхания до 30-40 в мин, в то время как слабый пневмотаксический сигнал может снизить частоту до 3-5 дыхательных движений в минуту.

Организация дыхательного центра
б) Вентральная группа дыхательных нейронов. Их участие во вдохе и выдохе. С двух сторон продолговатого мозга — около 5 мм впереди и латерально от дорсальной группы дыхательных нейронов — лежит вентральная группа дыхательных нейронов, расположенная рострально в nucleus ambiguus и каудально — в nucleus retroambiguus. Функции этой группы нейронов имеют некоторые важные отличия от функций дыхательных нейронов дорсальной группы.
1. Во время нормального спокойного дыхания дыхательные нейроны вентральной группы остаются почти полностью неактивными. Нормальное спокойное дыхание вызывается только повторением инспираторных сигналов от дорсальной группы респираторных нейронов, передающихся главным образом в диафрагму, и выдох совершается под влиянием эластической тяги легких и грудной клетки.
2. Нет никаких данных об участии дыхательных нейронов вентральной группы в основной ритмической осцилляции, регулирующей дыхание.
3. Когда импульсация, вызывающая усиление легочной вентиляции, становится больше нормы, генерация дыхательных сигналов начинает проводиться от основного осциллирующего механизма в дорсальной группе нейронов к дыхательным нейронам вентральной группы. В результате нейроны вентральной группы будут участвовать в создании дополнительной импульсации. 4. Электрическая стимуляция некоторых нейронов вентральной группы вызывает вдох, стимуляция других — выдох. Следовательно, эта группа нейронов участвует как в создании вдоха, так и в создании выдоха. Они являются особо важными для создания мощных экспираторных сигналов, передаваемых мышцам живота во время затрудненного выдоха. Таким образом, эта группа нейронов работает в основном как усиливающий механизм при необходимости сильного увеличения легочной вентиляции, особенно при тяжелой физической нагрузке.
в) Сигналы о растяжении легких ограничивают вдох. Рефлекс растяжения Геринга-Брейера. В дополнение к центральным нервным механизмам регуляции дыхания, находящихся в пределах ствола мозга, в регуляции дыхания принимают участие и сигналы от рецепторов в легких. Наиболее важными являются рецепторы растяжения, расположенные в мышечных участках стенок бронхов и бронхиол всех участков легких, которые в случае перерастяжения легких передают сигналы через блуждающие нервы в дорсальную группу дыхательных нейронов. Эти сигналы действуют на вдох так же, как это делают сигналы из пневмотаксического центра: при перерастяжении легких рецепторы растяжения активируют обратную связь, которая «выключает» импульсацию вдоха и приостанавливает вдох. Это называют рефлексом растяжения Геринга-Брейера. Рефлекс вызывает также учащение дыхания, как это делают и сигналы от пневмотаксического центра.
Похоже, что у человека рефлекс Геринга-Брейера активируется только после того, как дыхательный объем увеличивается более чем в 3 раза (становится больше 1,5 л). Предполагают, что этот рефлекс представляет собой в основном защитный механизм для предотвращения излишнего растяжения легких и не является важным компонентом при нормальной регуляции дыхания.
— Также рекомендуем «Активность дыхательного центра. Химическая регуляция дыхания»
Оглавление темы «Регуляция дыхания и газообмена»:
1. Транспорт кислорода в растворенном виде. Вытеснение кислорода
2. Транспорт двуокиси углерода кровью. Диссоциация двуокиси углерода
3. Эффект Холдейна. Изменение кислотности крови
4. Дыхательный коэффициент. Дыхательный центр
5. Пневмотаксический центр. Вентральная группа дыхательных нейронов
6. Активность дыхательного центра. Химическая регуляция дыхания
7. Влияние кислорода на дыхательный центр. Роль кислорода в регуляции дыхания
8. Феномен акклиматизации. Дыхание при физической нагрузке
9. Механизмы регулирования дыхания при физической нагрузке. Нейрогенная регуляция
10. Функция J-рецепторов легких. Механизм дыхания Чейн-Стокса
Источник
Рефлекторная регуляция дыхания осуществляется благодаря тому, что нейроны дыхательного центра имеют связи с многочисленными механорецепторами дыхательных путей и альвеол легких и рецепторов сосудистых рефлексогенных зон.
Рецепторы легких1
В легких человека находятся следующие типы механорецепторов:
рецепторы растяжения гладких мышц дыхательных путей; Легочные рецепторы растяжения
ирритантные, или быстроадаптирующиеся, рецепторы слизистой оболочки дыхательных путей;
J-рецепторы.
Легочные рецепторы растяжения
Полагают, что эти рецепторы залегают в гладких мышцах воздухоносных путей.
Если легкие длительно удерживаются в раздутом состоянии, то активность рецепторов растяжения изменяется мало, что говорит об их слабой адаптируемости.
Импульсация от этих рецепторов идет по крупным миелиновым волокнам блуждающих нервов. Перерезка блуждающих нервов устраняет рефлексы с этих рецепторов.
Основной ответ на возбуждение легочных рецепторов растяжения — уменьшение частоты дыхания в результате увеличения времени выдоха. Эта реакция называется инфляционным рефлексом Геринга — Брейера. (т. е. возникающим в ответ на раздувание)
В классических экспериментах показано, что раздувание легких приводит к затормаживанию дальнейшей активности инспираторных мышц.
Существует и обратная реакция, т. е. увеличение этой активности в ответ на уменьшеие объема легких (дефляционный рефлекс). Эти рефлексы могут служить механизмом саморегуляции по принципу отрицательной обратной связи.
Когда-то считалось, что рефлексы Геринга—Брейера играют основную роль в регуляции вентиляции, т. е. именно от них зависит глубина и частота дыхания. Принцип такой регуляции мог бы заключаться в модулировании работы «прерывателя вдоха» в продолговатом мозге импульсацией от рецепторов растяжения. Действительно, при двустороннем пе^ ререзании блуждающих нервов у большинства животных устанавливается глубокое редкое дыхание. Однако в последних работах было показано, что у взрослого человека рефлексы Геринга—Брейера не действуют, пока дыхательный объем не превосходит 1 л (как, например, при физической нагрузке). Кратковременная двусторонняя блокада блуждающих нервов посредством местной анестезии у бодрствующего человека не влияет ни на частоту, ни на глубину дыхания. Некоторые данные указывают, что эти рефлексы могут иметь большее значение для новорожденных.
Рефлексы со слизистой оболочки полости носа. Раздражение ирритантных рецепторов слизистой оболочки полости носа, например табачным дымом, инертными частицами пыли, газообразными веществами, водой вызывает сужение бронхов, голосовой щели, брадикардию, снижение сердечного выброса, сужение просвета сосудов кожи и мышц. Защитный рефлекс проявляется у новорожденных при кратковременном погружении в воду. У них возникает остановка дыхания, препятствующая проникновению воды в верхние дыхательные пути.
Рефлексы с глотки. Механическое раздражение рецепторов слизистой оболочки задней части полости носа вызывает сильнейшее сокращение диафрагмы, наружных межреберных мышц, а следовательно, вдох, который открывает дыхательный путь через носовые ходы (аспирационный рефлекс). Этот рефлекс выражен у новорожденных.
Рефлексы с гортани и трахеи. Многочисленные нервные окончания расположены между эпителиальными клетками слизистой оболочки гортани и главных бронхов. Эти рецепторы раздражаются вдыхаемыми частицами, раздражающими газами, бронхиальным секретом, инородными телами. Все это вызывает кашлевой рефлекс, проявляющийся в резком выдохе на фоне сужения гортани и сокращение гладких мышц бронхов, которое сохраняется долгое время после рефлекса.
Кашлевой рефлекс является основным легочным рефлексом блуждающего нерва.
Рефлексы с рецепторов бронхиол. Многочисленные миелинизированные рецепторы находятся в эпителии внутрилегочных бронхов и бронхиол. Раздражение этих рецепторов вызывает гиперпноэ, бронхоконстрикцию, сокращение гортани, гиперсекрецию слизи, но никогда не сопровождается кашлем.
Рецепторы наиболее чувствительны к трем типам раздражителей: 1) табачному дыму, многочисленным инертным и раздражающим химическим веществам;
2) повреждению и механическому растяжению дыхательных путей при глубоком дыхании, а также пневмотораксе, ателектазах, действии бронхоконстрикторов;
3) легочной эмболии, легочной капиллярной гипертензии и к легочным анафилактическим феноменам.
Рефлексы с J-рецепторов. В альвеолярных перегородках в контакте с капиллярами находятся особые J-рецепторы. Эти рецепторы особенно чувствительны к интерстициальному отеку, легочной венозной гипертензии, микроэмболии, раздражающим газам и ингаляционным наркотическим веществам, фенилдигуаниду (при внутривенном введении этого вещества). Стимуляция J-рецепторов вызывает вначале апноэ, затем поверхностное тахипноэ, гипотензию и брадикардию.
Рефлексы Геринга — Брейера.
Раздувание легких у наркотизированного животного рефлекторно тормозит вдох и вызывает выдох. Нервные окончания, расположенные в бронхиальных мышцах, играют роль рецепторов растяжения легких. Их относят к медленно адаптирующимся рецепторам растяжения легких, которые иннервируются ми-елинизированными волокнами блуждающего нерва.
Рефлекс Геринга — Брейера контролирует глубину и частоту дыхания. У человека он имеет физиологическое значение при дыхательных объемах свыше 1 л (например, при физической нагрузке). У бодрствующего взрослого человека кратковременная двусторонняя блокада блуждающих нервов с помощью местной анестезии не влияет ни на глубину, ни на частоту дыхания.
У новорожденных рефлекс Геринга — Брейера четко проявляется только в первые 3—4 дня после рождения.
Проприоцептивный контроль дыхания. Рецепторы суставов грудной клетки посылают импульсы в кору больших полушарий и являются единственным источником информации о движениях грудной клетки и дыхательных объемах.
Межреберные мышцы, в меньшей степени диафрагма, содержат большое количество мышечных веретен. Активность этих рецепторов проявляется при пассивном растяжении мышц, изометрическом сокращении и изолированном сокращении интрафузальных мышечных волокон. Рецепторы посылают сигналы в соответствующие сегменты спинного мозга. Недостаточное укорочение инспираторных или экспираторных мышц усиливает импульсацию от мышечных веретен, которые через у-мотонейроны повышают активность о-мотонейронов и дозируют таким образом мышечное усилие.
Хеморефлексы дыхания. Рог и Рсог в артериальной крови человека и животных поддерживается на достаточно стабильном уровне, несмотря на значительные изменения потребления Оз и выделение С02. Гипоксия и понижение рН крови (ацидоз) вызывают усиление вентиляции (гипервентиляция), а гипероксия и повышение рН крови (алкалоз) — понижение вентиляции (гиповентиляция) или апноэ. Контроль за нормальным содержанием во внутренней среде организма 02, СОг и рН осуществляется периферическими и центральными хеморецепторами.
Адекватным раздражителем для периферических хеморецепторов является уменьшение Ро; артериальной крови, в меньшей степени увеличение Рсо2 и рН, а для центральных хеморецепторов — увеличение концентрации Н* во внеклеточной жидкости мозга.
Артериальные (периферические) хеморецепто-ры. Периферические хеморецепторы находятся в каротидных и
аортальных тельцах. Сигналы от артериальных хеморецепторов по синокаротидным и аортальным нервам первоначально поступают к нейронам ядра одиночного пучка продолговатого мозга, а затем переключаются на нейроны дыхательного центра. Ответ периферических хеморецепторов на понижение Рао^ является очень быстрым, но нелинейным. При Рао; в пределах 80—60мм рт. ст. (10,6—8,0 кПа) наблюдается слабое усиление вентиляции, а при Рао; ниже 50 мм рт. ст. (6,7 кПа) возникает выраженная гипервентиляция.
Расо2 и рН крови только потенцируют эффект гипоксии на артериальные хеморецепторы и не являются адекватными раздражителями для этого типа хеморецепторов дыхания.
Реакция артериальных хеморецепторов и дыхания на гипоксию. Недостаток С>2 в артериальной крови является основным раздражителем периферических хеморецепторов. Импульсная активность в афферентных волокнах синокаротидного нерва прекращается при Раод выше 400 мм рт. ст. (53,2 кПа). При нормоксии частота разрядов синокаротидного нерва составляет 10% от их максимальной реакции, которая наблюдается при Раод около 50 мм рт. ст. и ниже-Гипоксическая реакция дыхания практически отсутствует у коренных жителей высокогорья и исчезает примерно через 5 лет у жителей равнин после начала их апаптации к высокогорью (3500 м и выше).
Центральные хеморецепторы.Окончательно не установлено местоположение центральных хеморецепторов. Исследователи считают, что такие хеморецепторы находятся в ростральных отделах продолговатого мозга вблизи его вентральной поверхности, а также в различных зонах дорсального дыхательного ядра.
Наличие центральных хеморецепторов доказывается достаточно просто: после перерезки синокаротидных и аортальных нервов у подопытных животных исчезает чувствительность дыхательного центра к гипоксии, но полностью сохраняется реакция дыхания на гиперкапнию и ацидоз. Перерезка ствола мозга непосредственно выше продолговатого мозга не влияет на характер этой реакции.
Адекватным раздражителемдля центральных хеморецепторов является изменение концентрации Н4 во внеклеточной жидкости мозга.Функцию регулятора пороговыхсдвигов рН в области центральных хеморецепторов выполняют структуры гематоэнцефали-ческого барьера, который отделяет кровь отвнеклеточной жидкости мозга. Через этот барьер осуществляется транспорт02, С02 и Н^между кровьюи внеклеточной жидкостью мозга.Транспорт СОз и H+ из внутреннейсреды мозга в плазмукрови черезструктуры гематоэнцефалического барьерарегулируется с участием фермента ка рбоангидразы.
50. Регуляция дыхания при пониженном и повышенном атмосферном давлении.
Дыхание при пониженном атмосферном давлении. Гипоксия
Атмосферное давление понижается при подъеме на высоту. Это сопровождается одновременным снижением парциального давления кислорода в альвеолярном воздухе. На уровне моря оно составляет 105 мм.рт.ст. На высоте 4000 м уже в 2 раза меньше. В результате уменьшается напряжение кислорода в крови. Возникает гипоксия. При быстром падении атмосферного давления наблюдается острая гипоксия. Она сопровождается эйфорией, чувством ложного благополучия, и скоротечной потерей сознания. При медленном подъеме гипоксия нарастает медленно. Развиваются симптомы горной болезни. Первоначально появляется слабость, учащение и углубление дыхания, головная боль. Затем начинаются тошнота, рвота, резко усиливаются слабость и одышка. В итоге также наступает потеря сознания, отек мозга и смерть. До высоты 3 км у большинства людей симптомов горной болезни не бывает. На высоте 5 км наблюдаются изменения дыхания, кровообращения, высшей нервной деятельности. На высоте 7 км эти явления резко усиливаются. Высота 8 км является предельной для жизнедеятельности высоте организм страдает не только от гипоксии, но и от гипокапнии. В результате снижения напряжения кислорода в крови возбуждаются хеморецепторы сосудов. Дыхание учащается и углубляется. Из крови выводится углекислый газ и его напряжение падает ниже нормы. Это приводит к угнетению дыхательного центра. Несмотря на гипоксию дыхание становится редким и поверхностным. В процессе адаптации к хронической гипоксии выделяют три стадии. На первой, аварийной, компенсация достигается за счет увеличения легочной вентиляции, усиления кровообращения, повышения кислородной емкости крови и т.д. На стадии относительной стабилизации происходят такие изменения систем, организма, которые обеспечивают более высокий, и выгодный уровень адаптации. В стабильной стадии физиологические показатели организма становятся устойчивыми за счет ряда компенсаторных механизмов. Так кислородная емкость крови увеличивается не только за счет возрастания количества эритроцитов, но и 2,3-фосфоглицерата в них. За счет 2,3-фосфоглицерата улучшается диссоциация оксигемоглобина в тканях. Появляется фетальный гемоглобин, имеющий более высокую способность связывать кислород. Одновременно повышается диффузионная способность легких и возникает «функциональная эмфизема». Т.е. в дыхание включаются резервные альвеолы и увеличивается функциональная остаточная емкость. Энергетический обмен понижается, но повышается интенсивность обмена углеводов.
Гипоксия это недостаточное снабжение тканей кислородом. Формы гипоксии:
1. Гипоксемическая гипоксия. Возникает при снижении напряжения кислорода в крови (уменьшение атмосферного давления, диффузионной способности легких и т.д.).
2. Анемическая гипоксия. Является следствием понижения способности крови транспортировать кислород (анемии, угарное отравление).
3. Циркуляторная гипоксия. Наблюдается при нарушениях системного и местного кровотока (болезни сердца и сосудов).
4. Гистотоксическая гипоксия. Возникает при нарушении тканевого дыхания (отравление цианидами).
Дыхание человека при повышенном давлении воздуха имеет место на значительной глубине под водой при работе водолазов или при кессонных работах. Поскольку давление одной атмосферы соответствует давлению столба воды высотой 10 м, то в соответствии с глубиной погружения человека под воду в скафандре водолаза или в кессоне поддерживается давление воздуха по этому расчету. Человек, находясь в атмосфере повышенного давления воздуха, не испытывает каких-либо дыхательных расстройств. При повышенном давлении атмосферного воздуха человек может дышать в том случае, если в его дыхательные пути поступает воздух под таким же давлением. При этом растворимость газов в жидкости прямо пропорциональна его парциальному давлению.
Поэтому при дыхании воздухом на уровне моря в 1 мл крови содержится 0,011 мл физически растворенного азота. При давлении воздуха, которым дышит человек, например, 5 атмосфер, в 1 мл крови будет содержаться в 5 раз больше физически растворенного азота. При переходе человека к дыханию при более низком давлении воздуха (подъем кессона на поверхность или всплытие водолаза) кровь и ткани тела могут удержать только 0,011 мл N2/мл крови. Остальное количество азота переходит из раствора в газообразное состояние. Переход человека из зоны повышенного давления вдыхаемого воздуха к более низкому его давлению должен происходить достаточно медленно, чтобы освобождающийся азот успел выделиться через легкие. Если азот, переходя в газообразное состояние, не успевает полностью выделиться через легкие, что имеет место при быстром подъеме кессона или нарушении режима всплытия водолаза, пузырьки азота в крови могут закупорить мелкие сосуды тканей организма. Это состояние называется газовая эмболия. В зависимости от локализации газовой эмболии (сосуды кожи, мышц, центральной нервной системы, сердца и др.) у человека возникают различные расстройства (боли в суставах и мышцах, потеря сознания), которые в целом называются «кессонной болезнью».
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Источник
