Лабораторные исследования при ожоге

Для того чтобы определить, имеет ли место ожоговая болезнь, в первую очередь необходимо знать возраст, площадь и глубину ожогового поражения, а для этого существует ряд методов.
Диагностика глубины поражения осуществляется клиническими методами, по данным анамнеза, с использованием диагностических проб и инструментальных методов.
Определение глубины поражения кожных покровов
Для определения глубины ожоговой травмы нужно учитывать:
Анамнез ожоговой травмы:
При изучении анамнеза ожоговой травмы обращают внимание на:
- температуру травмирующего агента (чем выше температура, тем глубже степень поражения кожи, повреждение тканей начинается при температуре 40°С и по мере увеличения нарастает в логарифмической прогрессии; при воздействии температуры > 45 °С всегда имеет место денатурация белков и восстановление тканей невозможно, но сам механизм смерти запускается при температуре тела 42°С («критически максимальная» температура));
- длительность экспозиции воздействия (чем дольше воздействие, тем глубже степень поражения кожи); известно, что экспозиция на коже человека воды, нагретой до 88 °С, в течение 1 с приводит к появлению глубокого ожога, лечение которого невозможно без выполнения аутодермопластической операции;
- теплопроводность травмирующего агента.
Местный осмотр ожоговых ран:
Гиперемия и отек кожи: может происходить гибель эпидермиса и верхнего слоя дермы, который отслаивается в виде тонкостенных пузырей, содержащих прозрачный желтоватый экссудат. При неосложнённом течении раны самостоятельное заживление (до 1012 дней) — поверхностные неглубокие ожоги по международной классификации болезней (МКБ) — 1 степень степень).
Частично глубокие ожоги по МКБ — степень (IIIA степень) -погибают все слои эпидермиса и дерма, самостоятельная эпителизация возможна при неосложненном течении раневого процесса в течение 3-4 недель за счет оставшихся в глубоких слоях дермы дериватов кожи (волосяные фолликулы, сальные, потовые железы). В случае нарушения микроциркуляции в ране наступает гибель оставшихся эпителиальных элементов и эпителизация не происходит. Формируется грануляционная ткань, требующая выполнения аутопластики. На месте самостоятельно заживших ожогов часто формируются грубые рубцы.
Глубокие ожоги по МКБ 3 степени (ШБ — IV) степень) характеризуются гибелью кожи, жировой клетчатки и анатомических образований, расположенных глубже собственной фасции: мышц, сухожилий, костей. Омертвевшие ткани могут формировать плотный сухой струп (каогуляционный некроз) или влажный рыхлый (каликвационный некроз). Самостоятельно не заживают.
Ожоги 1 и 2 степени относятся к поверхностным и обычно заживают самостоятельно при консервативном неосложнённом лечении. Ожоги 3 степени являются глубокими и требуют оперативного лечения.
Применение диагностических проб:
1. Укол иглой
A. 1 степень — гиперестезия, касание тупым концом иглы может восприниматься как болевое.
Б. 2 степень — часто имеется гипостезия и при поверхностных уколах не возникает чувство боли.
B. 3 степень — глубокие уколы на всю толщину кожи безболезненны.
2. Проба «волоска» (эпиляционный тест): эпиляция волоска при поверхностных ожогах болезненна и волос крепко держится в тканях, а при глубоких — выдёргивается безболезненно и легко (в результате деструкции дермы).
3. Аппликация к раневой поверхности марлевого шарика, смоченного раздражающими жидкостями (используют этиловый спирт, бензин, редко растворы поваренной соли и другие).
4. Определение капиллярного пульса.
Инструментальные методы исследования:
Использование красителей:
А. На ожоговую поверхность наносят красители с низкой острой токсичностью: дисульфанового синего, синего Эванса, димифена голубого, конго красного, голубого бромфенола, и др. При окраске тканей 0,2% кислым фуксином в полунасыщенном 1% растворе пикриновой кислоты поверхностные ожоги приобретают ярко-розовую окраску, а глубокие — ярко-желтую
Б. Внутривенное введение флюоресцентных красителей: окситетрациклин, флюоресцеин, и др., при этом ожоговые поверхности облучали ультрафиолетовой лампой. Пример: После приема окситетрациклина через 1 ч при облучении ожогов кварцевой лампой в темном помещении видно желтое свечение поверхностных ожогов и отсутствие свечения в области глубоких ожогов. Этот способ определения глубины не нашёл широкого применения и представляет собой исторический интерес.
Использование радиоактивных изотопов (в/венное введение изотопов Р32 и Хе133).
Импедансометрия. Метод основан на измерении полного сопротивления переменного тока на разных частотах и последующем определении коэффициента поляризации. При деструктивных процессах в тканях коэффициент поляризации склонен к снижению.
Термография. Проводится с помощью тепловизора или контактным методом. При наличии влажного струпа термографическая картина искажена.
Термометрия.
Полярография.
Ультразвуковое исследование.
Лазерная допплерография
Определение рН.
Инфракрасное зондирование.
Гистологические и гистохимические методы диагностики (большая подготовка проб для анализа).
Хотелось бы отметить, что в нынешнее время многие методы диагностики в детской практике не применяются в силу своих сложных манипуляций, аллергических реакций, возникающих осложнений.
На глубину поражения также влияют:
• состояние кожного покрова до ожога,
• цвет кожи,
• возраст пострадавшего,
• локализация ожога (на участках тела с тонкой кожей чаще возникают глубокие ожоги).
А.В. Глуткин, В.И. Ковальчук
Опубликовал Константин Моканов
Источник

Лабораторная диагностика ожоговой болезни

Изменение содержания общих липидов и липопротеидов крови • Первоначально: ↑ мобилизации резервных жиров из жировых депо, поступление их в кровь → ↑ содержания общих жиров в плазме крови. • Этому способствуют: 1. Усиление О-В процессов вследствие ожоговой травмы; 2. ↓ активности липопротеиновой липазы → нарушается переход жирных кислот из хиломикронов плазмы крови в жировые депо; 3. Раздражение симпатического отдела автономной нервной системы → повышенное освобождение из нервных окончаний катехоламинов ( в частности, адреналина, который стимулирует образование аденилатциклазы, а через нее – синтез ц. АМФ, активирующей гормончувствительную липазу).

• Поступление большого количества свободных жирных кислот из крови в печень индуцирует повышение интенсивности процессов ресинтеза триглицеридов и образования ЛПОНП, которые вновь поступают в кровь для последующего транспортирования в ткани. • Т. о. , при ожоговой болезни в начальные периоды в плазме увеличивается содержание ЛПОНП, вызванное мобилизацией резервных жиров из жировых депо.

• Однако при недостатке холестерина и лецитина часть триглицеридов не включается в белково-липидные комплексы, а накапливается в печени в свободном виде. Это ведет к жировой инфильтрации печени, которая может перейти в запущенных и тяжелых случаях в жировое перерождение печени.

• Этому процессу способствует: 1. Гипоксия и истощение запаса углеводов в печени → ↓ скорости синтеза фосфолипидов при усилении мобилизации депонированных жиров; 2. Дефицит белков в организме и использование некоторых аминокислот (метаболизм которых связан с образованием ацетил-Ко. А) для липогенеза; 3. Ограничение обменной мощности цикла Кребса, в результате чего ацетил-ifo. А, интенсивно образующийся при липолизе, в меньшей степени подвергается дальнейшему окислению и поэтому используется на биосинтез нейтральных жиров; 4. Снижение гликогенобразовательной функции печени.
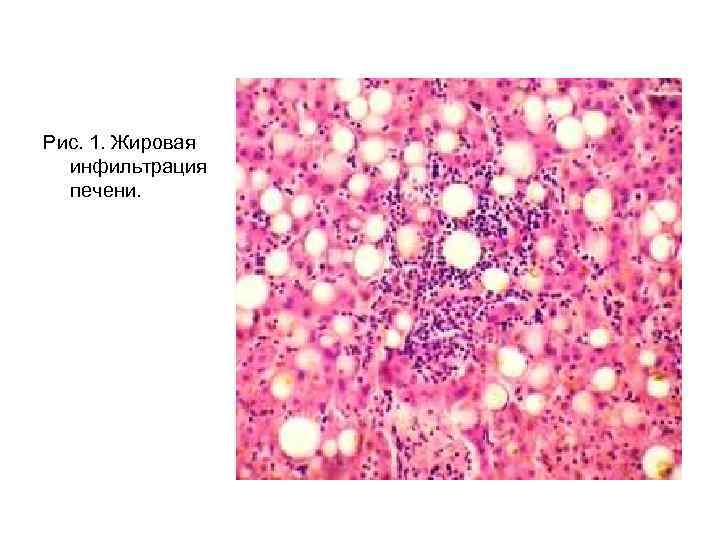
Рис. 1. Жировая инфильтрация печени.

• Но повышение содержания липидов в крови характерно только для ранних стадий ожоговой болезни. Затем развиваются обратные процессы: наступает истощение жировых депо, снижается поступление свободных жирных кислот в кровь и печень, поэтому нарушается синтез триглицеридов и ЛПОНП (в результате снижения интенсивности синтеза фосфолипидов и холестерина, являющихся компонентами липопротеидов).

• При этом экзогенные жиры не могут полностью обеспечить удовлетворение потребностей организма, т. к. из-за нарушения работы пищеварительного тракта они очень плохо усваиваются в желудке и кишечнике. Развивается гиполипидемия.

• Таким образом, уровень содержания отдельных фракций липидов и липопротеидов в крови находится в динамическом равновесии с содержанием таковых в тканях и внутренних органах (особенно в печени). Нарушения работы отдельных звеньев этой цепи приводят к резким сдвигам жирового метаболизма, что отражается на состоянии печени и приводит к ее различным морфофизиологическим изменениям.

Изменения обмена белков и аминокислот • При ожоговой болезни развивается белковая недостаточность. ПРИЧИНЫ: 1) Основной причиной белкового дефицита считается потеря белка в области раны. Механизм: 1. Клетки капилляров обожженной области становятся столь же проницаемыми для молекул белков, как и нормальные капилляры для ионов.

Такое увеличение проницаемости стенки сосудов принято связывать с системой гиалуроновой кислоты и активацией гиалуронидазы. Кроме того, по некоторым данным, при ожоге содержание белковых фракций, влияющих на проницаемость капилляров, в коже резко снижается, в то время как в крови и лимфе оно возрастает.

Это свидетельствует о повышении проницаемости сосудистой стенки капилляров во всем организме, что индуцирует выход белка за пределы сосудистого русла и в необожженных областях. 2. Через 24 -48 часов после ожога плазмопотеря резко уменьшается. Она заменяется обильной экссудацией кожи, которая возникает в результате развития в ней воспалительной реакции и сопровождается постоянной потерей белка через раневую поверхность.

2) Существенной причиной белкового дефицита является усиленный генерализованный распад белка в организме. Это непосредственно связано с нарушением аминокислотного обмена при ожоговой болезни. Было замечено, что в начальные периоды заболевания распад белков идет, как правило, полностью (до аминокислот). В более поздние периоды процессы распада носят незавершенный характер – в результате образуются преимущественно пептидные фрагменты, а не свободные аминокислоты.

3) Кроме того, имеют место специфические расстройства обмена отдельных аминокислот. Особую роль играет нарушение процессов окисления циклических аминокислот (фенилаланина, триптофана, тирозина и др. ). 4) Также в качестве дополнительного пути потери белка выступает усиление его экскреции с мочой в результате нарушения проницаемости стенок почечных канальцев.

5) Нарушения синтеза белка, обусловленные снижением пептической активности желудочного сока, а также сдвигами функционального состояния печени. • Возникает изменение содержания различных фракций белка уже в первые часы после ожога. Альбумины. Характерно абсолютное снижение содержания альбуминов в плазме, которое достигает своего максимума на 10 -15 день заболевания, после чего их концентрация начинает постепенно возрастать (через 2 недели), но длительное время не достигает нормы. Причем ограниченные глубокие ожоги сопровождаются более значительным падением концентрации альбуминов в крови, чем обширные оверхностные ожоги.

α 1 — и α 2 -глобулины. Характерно быстрое нарастание как абсолютного, так и относительного их количества в плазме крови. Причем концентрация α 1 -глобулинов повышается быстрее, достигая своего максимума уже на 5 -7 день болезни, но она раньше начинает снижаться. Содержание α 2 -глобулинов дает наибольший подъем к 7 -15 дню. Далее концентрация этих фракций начинает постепенно снижаться и достигает нормы при выздоровлении.

β-глобулины. Их содержание колеблется в пределах нормы. γ- глобулины. Их концентрация до пятого дня болезни находится в пределах нормы, затем начинает быстро возрастать и достигает максимального значения на 15 й день заболевания. В последующем она держится на этом уровне. Функция γ- глобулинов — защитная, они удаляют из крови различные ожоговые токсины и защищают организм от проникновения патогенной макрофлоры.

Нарушения углеводного обмена • В первые часы ожоговой болезни развивается гипергликемия и глюкозурия. Затем с развитием ожоговой инфекции и токсемии происходит снижение уровня сахара в крови и исчезновение глюкозурии. В некоторых случаях наблюдается вторая волна гипергликемии.

• При развитии ожогового истощения снова наступает патологическое снижение уровня глюкозы. Это связано с длительным угнетением работы коры надпочечников и с активацией функционирования инсулярного аппарата поджелудочной железы. В период реконвалесценции количество сахара в крови возвращается к норме, что сопровождается нормализацией глюкокортикоидной функции коры надпочечников.

• В момент термической травмы в организме выделяется большое количество катехоламинов. Происходит активация расщепления гликогена в печени за счет перехода фосфорилазы В в фосфорилазу А, происходящего под действием адреналина. Поэтому в течение первых нескольких часов после травмы организм может поддерживать необходимый уровень глюкозы в крови до тех пор, пока запасы гликогена в печени (около 200 г) не будут исчерпаны.

• Далее для поддержания необходимого уровня гликемии будут активироваться резервные механизмы, основанные на глюконеогенезе. Причем источником для синтеза глюкозы в этом случае являются аминокислоты белков мышечных клеток, имеющие разветвленную цепь: валин, изолейцин, лизин.

• Несмотря на повышение интенсивности синтеза инсулина степень утилизации глюкозы тканями в посттравматическом периоде снижается. Это объясняется взаимодействием продуктов распада с инсулиновыми мембранными рецепторами, которые в результате этого теряют способность реагировать с молекулами инсулина, а также нарушениями пострецепторного звена. Измененный инсулиновый ответ тканей также может быть результатом активации гипоталамо- гипофизарной системы в результате стресса, в связи с чем в первые часы после травмы повышается продукция стероидов.

• Такая недостаточная утилизация глюкозы тканями и невозможность использования ее в качестве источника энергии для клеток приводит к дальнейшему разрушению аминокислот, с помощью которого поддерживается достаточный уровень энергообеспечения организма.

Нарушение работы цикла Кребса при ожоговой болезни. • При ожогах содержание цитрата в печени уменьшается, что свидетельствует о снижении интенсивности синтеза лимонной кислоты. Это является следствием уменьшения окислительного декарбоксилирования пирувата, а также нарушения цитратсинтазной реакции.

• Уменьшение содержания цитрата сказывается на следующих процессах: 1. Перенос водорода в различных биосинтетических реакциях; 2. Восстановление НАД в изоцитратдегидрогеназной реакции; 3. Аллостерическая регуляция активности изоцитратдегидрогензы, фосфофруктокиназы и др. ; 4. Процессы синтеза ВЖК и ацетилхолина и т. д.

• Содержание α-кетоглутарата в печени на начальных этапах ожоговой болезни увеличивается. Причина – интенсификация его образования из различных источников (глутаминовой кислоты, аргинина и др. ), а также нарушение процессов его дальнейшего окисления (т. к. снижается активность α- кетоглутаратдегидрогеназы).

• В ранние периоды ожоговой болезни снижается содержание оксалоацетата (ЩУК) в результате снижения активности митохондриальной малатдегидрогеназы. Вследствие этого снимается его ингибирующее влияние на сукцинатдегидрогеназную реакцию. При этом снижается интенсивность малатдегидрогеназной реакции в печени, в то время как активность цитоплазматической малатдегидрогеназы повышается. Это обеспечивает возможность накопления яблочной кислоты, играющей важную роль в поддержании достаточной концентрации сукцината.

Метаболические превращения пирувата в печени при ожоговой болезни. • Содержание ПВК в ранние стадии ожоговой болезни повышено. Это объясняется нарушением окислительного декарбоксилирования, что подтверждает уменьшение потребления кислорода митохондриями печени. В связи с такими изменениями у ожоговых больных часто имеется гиперпируватемия. Кроме того, это является важным фактором в развитии недостаточности энергообразования.

• Ограничение окислительного декарбоксилирования пирувата приводит к утилизации его по другим метаболическим путям, в частности в ходе лактатдегидрогеназной реакции. • Причины снижения интенсивности окислительных превращений пирувата в печени: 1. Уменьшение содержания витамина В в печени; 2. Преобладание восстановленных форм НАДН+Н над окисленными формами; 3. Изменения компонентов пируватдегидрогеназного комплекса (таких как HS-Ко. А, липоата и др. ); 4. Повышение концентрации ацетил-Ко. А вследствие интенсификации липолитических процессов после термических повреждений.

Изменение водно-солевого обмена при ожоговой болезни • В период шока формируется ожоговый отек. Он связан с задержкой воды в организме. При этом снижается количество выделяемой мочи (диурез равен 0, 85 мл/мин). Моча гипертоническая, с высокой осмотической концентрацией при снижении осмотической концентрации сыворотки крови (антидиуретическая активность).

• Во втором периоде болезни происходит повышение диуреза до 1, 71 мл/мин, осмолярность мочи снижается, а показатель осмолярности сыворотки крови остается пониженным. • В периоде септикотоксемии происходит нормализация осмотических сдвигов: осмотическое давление сыворотки ↑, диурез ↑, осмолярность мочи ↓. • В период реконвалесценции основные осмотические показатели постепенно возвращаются к норме.

• При ожоговой болезни нарушается баланс различных ионов. Кальций. Содержание ионов в крови в первое время понижено, затем повышается. Фосфор. Концентрация ионов увеличена в течение всего периода болезни. Причина – нарушение процессов окислительного фосфорилирования, изменение энергетического и других обменных процессов, а также распад поврежденных ожогом тканей.

Магний. Баланс ионов в первое время отрицателен, т. к. происходит повышение их экскреции с калом, мочой и экссудатом. Натрий. В стадии шока и ожоговой токсемии происходит значительное снижение выделения натрия и его задержка в организме. В период септикотоксемии баланс натрия становится отрицательным. Нормализация содержания ионов — в период выздоровления.

Калий. В трех первых периодах болезни сохраняется отрицательный баланс ионов калия в результате резкого увеличения почечной экскреции этого иона. Положительным баланс становится только после очищения раны от струпа.

• Основной причиной нарушения баланса ионов в организме ожогового больного в первые периоды болезни является изменение проницаемости биомембран. Так, при ожоговой болезни нарушаются процессы пассивного и активного транспорта ионов натрия и калия через эритроцитарные мембраны.

• Пассивная проницаемость мембраны эритроцитов для ионов натрия резко возрастает. Вследствие этого в термически поврежденную клетку устремляется больше ионов натрия, чем выходит ионов калия. Поэтому возникает гипотония внеклеточной жидкости и в поврежденные клетки устремляется вода. Формируется ожоговый отек.

• Чтобы избежать набухания и разрыва мембраны эритроцитов необходимо откачивать ионы путем активного транспорта с помощью фермента Na-K-АТФ-азы. Повышение АТФ-азной активности приводит к снижению уровня АТФ к клетках. Поэтому гидролиз АТФ, обеспечивающий энергией процессы активного транспорта ионов натрия из клетки в межклеточное пространство, при ожоговой болезни не может осуществляться в полной мере. Работа натриевого насоса нарушается, он не успевает откачивать натрий из клетки, в результате чего жизнедеятельность эритроцитов нарушается.

Влияние ожоговой травмы на эритроциты • Дефицит эритроцитарной массы проявляет себя на третьи сутки после ожога снижением числа эритроцитов и содержания гемоглобина. Развивающаяся анемия носит гемолитический характер. • В дальнейшем, в течение всего времени существования гнойно-некротической ожоговой раны наблюдается стойкая клиническая картина малокровия, носящая наиболее выраженный характер у пациентов с обширными (более 10%поверхности тела) глубокими ожогами.

• В период реконвалесценции полное восстановление количественных параметров красной крови отмечается не всегда. • Снижение жизнеспособности эритроцитов обусловлено комплексом изменений их структурных, метаболический и функциональных свойств. При этом в эритроцитах значительно уменьшается концентрация тиоловых соединений и липопротеидов.

• Происходит увеличение доли эритроцитов с пониженным и низким содержанием этих субстратов, а также в кровеносном русле появляются форменные элементы с предельно низкой концентрацией тиоловых групп и липопротеинового комплекса, не встречающиеся в периферической крови здоровых людей. Все эти изменения приводят к сокращению периода циркуляции эритроцитов в кровеносном русле.

• Эти преобразования происходят в результате активации комплекса патологических факторов воздействия термического агента. В частности, характерны активация протеолиза, липопероксидация, инициация эндогенных фосфолипаз и др. Они усугубляют обусловленное основными процессами гипоксическое состояние.

• В более поздние периоды болезни отмеченные нарушения сохраняются. Даже через 2 месяца после ожога выявляются отчетливые признаки структурно-метаболической дестабилизации циркулирующих эритроцитов, связанной с недостаточностью тиоловых групп и уровня липопротеидов, со снижением осмотической резистентности, с увеличением количества дегенеративно- измененных форм клеток, с изменением поверхностной и внутриклеточной ультраструктуры красных кровяных клеток.

Лабораторная диагностика • ОАК: -общий белок крови; -липидный спектр (ТГЦ, ЛПОНП, ЛПНП, свободные ЖК); -глюкоза; -электролиты; -кислотно-щелочное состояние. • ОАМ: -белок; -глюкоза; -осмолярность.

Термическая травма – это не просто локальное повреждение, она вызывает целый комплекс реакций во всем организме, называемый ожоговой болезнью. Прогрессирование изменений в организме опасно. Возможно развитие осложнений или смерть ожогового больного(ожоговое истощение, дистрофия печени, присоединение сепсиса и др. ).
Источник
